
por Fernando Landulfo fotos Leonardo Barboza
Ferrugem é o nome popular dado ao hidróxido de ferro (Fe(OH)3), que aparece sobre os metais ferrosos, quando se encontram oxidados e corroídos, na forma de uma camada marrom alaranjada. E por essa razão, criou-se o mito que ferrugem, oxidação e corrosão são a mesma coisa.
No entanto, de acordo com alguns autores e empresas especializadas no assunto: não são.
OXIDAÇÃO
De acordo com o professor Diogo Dias1, é o processo de perda de elétrons, grupo de átomos ou íons, durante uma reação química.
Ela é caracterizada pelo aumento do número de oxidação dos elementos, quando comparados nos papéis de reagente e produto.
Segundo essa mesma fonte, toda reação de oxidação é acompanhada por uma reação de redução (ganho de elétrons) que provoca uma diminuição do número de oxidação do elemento.
Por sua vez, Quimatic2 complementa que esse processo pode ocorrer com todos os metais. O motivo mais comum para que isso ocorra é o contato dos mesmos com oxigênio do ar e água na forma de vapor (umidade do ar) ou contato direto (na forma líquida). Por essa razão, esse conjunto de reações é conhecido por reação de oxirredução.
Segundo a professora Mayara Cardoso:
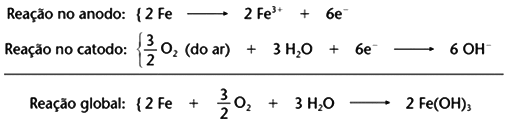
O número de oxidação do Ferro passa de zero (reagente: substância simples) para +3 (produto). Já o número de oxidação do oxigênio passa de zero (reagente:
substância simples) para -2.
A professora Jeniffer Fogaça3 complementa que nos litorais, devido à presença de íons na água do mar, a chamada “maresia”, quando em contato com os metais, forma uma ponte salina que possibilita a reação de oxirredução entre o oxigênio do ar e os metais. Por isso que nesses locais o processo é mais rápido e intenso.

CORROSÃO
Segundo Quimatic, corrosão é o desgaste do metal a partir da oxidação. Tal posição é sustentada pela professora Mayara Cardoso4, que afirma que corrosão “é a deterioração de metais causada por processos eletroquímicos das reações de oxirredução”.

FERRUGEM
Quimatic define ferrugem como sendo apenas a camada marrom avermelhada de hidróxido de ferro que se acumula sobre o metal oxidado e corroído.
Pois bem, seja lá qual for o nome utilizado, essa praga vem assolando os veículos por décadas. Hoje a incidência é infinitamente menor. Porém, ainda ocorre.
Mas no passado… Quantas preciosidades não poderiam ainda estar aqui conosco, se não tivessem sido, pouco a pouco destruídas pela ferrugem.
Quem tem um pouco mais de idade lembra muito bem. Nos anos 70 e 80, era muito comum um carro novo começar a apresentar ferrugem com apenas um ou dois anos de uso. E nem bem o “ponto inicial” era tratado, já aparecia outro. Alguns modelos eram conhecidos por apresentar ferrugem crônica em determinadas partes.
Mas qual a causa? Bem, vários eram os fatores. Entre eles:
- Uso de chapas de aço com baixa liga na fabricação das peças (mais baratas);
- Uso de solda oxi acetilênica na montagem da carroçaria;
- Preparação superficial da carroçaria antes da pintura pouco eficiente (não se fazia a proteção galvânica);
- Pintura e proteção das chaparias pouco eficientes;
- Presença de pontos de acumulo de água sem a devida proteção com fundos especiais.

CORROSÃO GALVÂNICA
No entanto, não é apenas o contato com o oxigênio e a água que provoca a ferrugem. A chamada corrosão galvânica é outra fonte bastante significativa. Trata-se de um processo eletroquímico no qual um metal corrói preferencialmente em relação a outro (atrai os elétrons do outro) quando se encontram em contato na presença de um eletrólito (substância ou material que permite a passagem de corrente elétrica).
Nessa situação, metais chamados menos nobres (maior potencial de oxidação ou anodo) tendem a corroer mais rápido quando em contato com os mais nobres (menor potencial de oxidação ou catodo). Nesse ponto, vale a pena destacar que quanto maior o potencial de oxidação de um metal, maior a sua tendência de perder elétrons.
Ou seja, manter em contato metais com diferentes potenciais de oxidação pode provocar corrosão deles, mesmo que as suas superfícies estejam pintadas e protegidas da água e do oxigênio.
A tabela a seguir mostra uma escala prática crescente de nobreza, de acordo com a CIMM5:
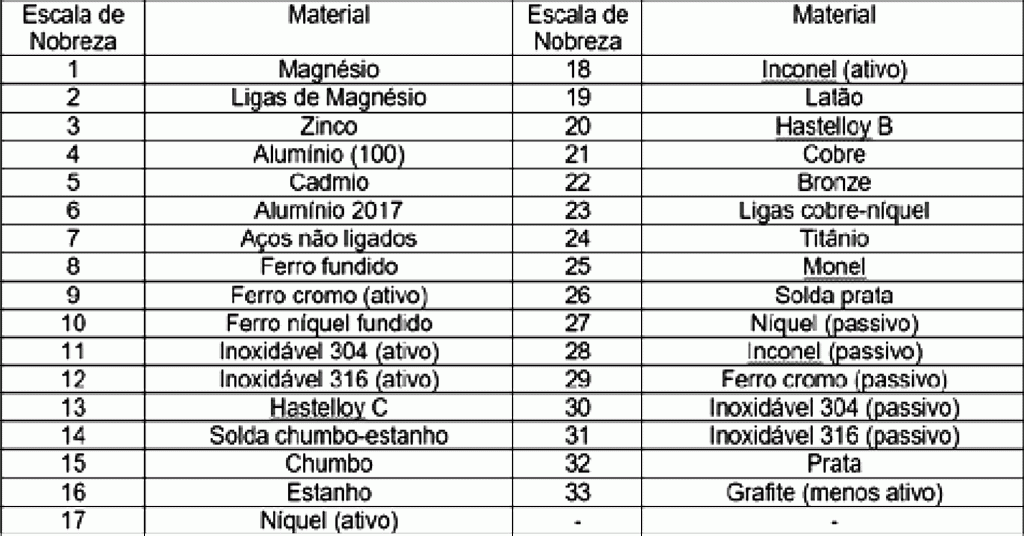
Mas como esse tipo de corrosão pode ocorrer em um veículo? Basta montar ou reparar uma carroçaria com chapas de aço de diferentes potenciais de oxidação (composição diferente). Da mesma forma, soldar ou preencher peças de aço com metal mais nobre também poderá provocar corrosão galvânica do mesmo.

E COMO PROTEGER OS VEÍCULOS DESSA PRAGA?
Como já diz aquele velho ditado: “é melhor prevenir do que remediar”. Mesmo os veículos mais modernos, cujas carroçarias possuem proteção galvânica, têm pontos mais frágeis com relação à proteção. Assim, manter o veículo limpo e a pintura em bom estado, com certeza ajudará na prevenção. Da mesma forma, evitar o acúmulo de água na carroçaria. Principalmente em regiões críticas como: debaixo de frisos, canaletas etc).
Se, por qualquer razão uma região ficar sem a camada de pintura, independente de ter ou não proteção galvânica, limpar, desengraxar e cobrir imediatamente com produtos protetivos como wash-primer ou galvanização a frio (pode ser na forma de um aerossol). Isso impedirá o inicio do processo de oxidação, até que seja feito o reparo definitivo da área.
Também é possível fazer uma proteção eletroquímica na carroçaria. Basta instalar anodos de sacrifício (pequenas peças de metal menos nobre do que o aço, como o magnésio) na carroçaria.
Esse material corroerá no lugar do aço.
Mas é preciso tomar alguns cuidados:
O material de sacrifício deve estar em contato com a chapa nua de aço. Todas as peças da carroçaria devem estar eletricamente conectadas.
Agora, se a ferrugem já se instalou é preciso, em primeiro lugar, removê-la.
Depois, proteger a área como exposto anteriormente.
Não, em hipótese alguma, usar o maçarico de acetileno para fazer esse serviço. Apesar de tornar o serviço mais fácil, esse tipo de chama expõe o metal ao oxigênio, podendo provocar nova corrosão a médio prazo. Ou seja: um tiro no pé.

O melhor a fazer é usar produtos removedores de ferrugem (existem vários por ai) ou a boa e velha escova de aço.
Mas é preciso ter cuidado, ao usar a escova: não vá remover material demais.
Nesse ponto, vale a pena mencionar que é preciso saber diferenciar entre produtos removedores e convertedores de ferrugem. O primeiro remove a ferrugem expondo o metal base. O segundo converte quimicamente a ferrugem em uma substância neutra. Segundo alguns fabricantes essa substância é protetora.
Jatear ou usar um banho de imersão ácido? Sim são soluções possíveis e viáveis. Principalmente no caso de grandes consertos (restauração). Mas é preciso ter cuidado. O serviço tem que ser feito por profissionais. Caso contrário, as chapas podem ficar deformadas ou muito finas.
Raios laser? Sem dúvida a melhor solução. Mas o equipamento é caro. Logo, os serviços também o são.
BIBLIOGRAFIA DESTE ARTIGO:
1 DIAS, Diogo Lopes. O que é oxidação? Disponível em: https://brasilescola.uol.com.br/o-que-e/quimica/oque-e-oxidacao.htm. Acesso em: 04/06/2019.
2 https://www.quimatic.com.br/blog/2017/03/entender-a-diferenca-entre-oxidacao-ferrugem-e-corrosao-garante-melhor-protecao-aos-metais/. Acesso em 01/06/2019.
3 FOGAÇA, Jennifer Lopes Vargas. Maresia e corrosão dos metais. Disponível em: https://brasilescola.uol.com.br/quimica/maresia-corrosao-dos-metais.htm. Acesso em 04/06/2019
4 CARDOSO, Mayara. Corrosão. Disponível em: https://www.infoescola.com/quimica/corrosao/.Acesso em 06/06/2019.


